FUENTE: EFE Salud
La última oleada del test serológico con el que el Instituto de Salud Carlos III mide el grado de inmunidad de la población española frente al nuevo coronavirus, un 5%, también ofrecía un dato inquietante: más del 14% de los testados había perdido los anticuerpos desde que se detectaron en la primera ronda del estudio, realizada en abril, hasta la última, en junio.
Sin embargo, no se puede dar por hecho que se haya perdido la inmunidad porque hayan desaparecido los anticuerpos en este grupo poblacional ya que existen otros mecanismos del sistema inmunitario que nos pueden proteger frente al virus que brotó en China y conocimos el pasado mes de diciembre.
¿Cuál es la certeza absoluta de cuánto dura la memoria inmunológica frente a SARS-COV-2? Hasta ahora sobre todo es una certeza clínica.
“A día de hoy no se han descrito reinfecciones, por eso, desde que hace más de seis meses hay casos de COVID-19 seguimos teniendo memoria inmunológica”, explica la doctora Carmen Cámara, secretaria de la SEI.
Pero también hay varias líneas de investigación abiertas para comprender hasta qué punto funciona nuestro sistema inmunitario contra el coronavirus y, sobre todo, son respuestas necesarias para avanzar el desarrollo de una vacuna eficaz.
Anticuerpos e inmunidad frente al virus
Las pruebas serológicas actuales miden si hemos generado anticuerpos tras ser infectados y lo hace frente a dos antígenos: la proteína Spike, la llave de entrada del virus en la célula humana, y la nucleoproteína que forma la cápsula del patógeno.
Nuevos antígenos podrían aumentar la sensibilidad de los test serológicos, aunque la experta considera que estos dos son fundamentales para la acción y detección del virus.
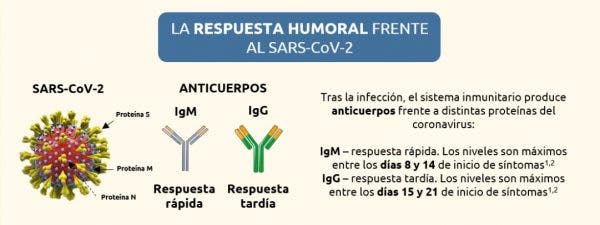
La inmunidad celular
Pero la memoria inmunitaria no solo se compone de anticuerpos, también está formada por células, en especial por los linfocitos B (los productores de los anticuerpos) y los linfocitos T, los soldados que luchan contra el virus, que podrían reactivarse si el virus volviera a infectarnos.
Es la llamada memoria inmune celular.
Por eso, aunque hayan desaparecido los anticuerpos, como se ha descrito en los casos leves y asintomáticos (con menor carga viral), podrían permanecer estas células defensivas de memoria, pero es necesario detectarlas.
Hasta ahora se ha medido el nivel de anticuerpos con técnicas que son rápidas, eficaces, baratas y automatizadas, por lo que se pueden realizar en gran cantidad, explica la doctora.
Pero medir la inmunidad celular, ver si nuestros linfocitos T se levantan contra el coronavirus, precisa de técnicas complejas, caras, que requieren tiempo y laboratorios y personal especializado.
Por esa razón, la SEI propone testar la inmunidad celular en los casos que han perdido los anticuerpos, en ese 14% de población recogida en el estudio serológico ENE-COVID.
“Sería dar un paso más en el conocimiento del virus a la vez que evitamos el desasosiego de pensar que si no tenemos anticuerpos, no tenemos inmunidad”, apunta la doctora que también forma parte de la Unidad de Inmunología del Hospital Universitario La Paz de Madrid.
“Los inmunólogos de la SEI tenemos esa experiencia y nos ponemos a disposición del Instituto Carlos III para seleccionar y realizar la técnica más adecuada para medir la memoria inmune celular”, propone la inmunóloga.
Pero, además, considera que los hospitales públicos también deberían analizar a ese grupo de pacientes que han tenido una infección detectada en radiografías pulmonares y con varias pruebas diagnósticas PCR positivas pero que, sorprendentemente, no han generado anticuerpos y que representan del 1 al 3% de afectados.
Para ello, los laboratorios de inmunología hospitalarios deberían contar con recursos materiales y expertos en estos cultivos celulares que sepan detectar la reactividad de los linfocitos T cuyo porcentaje es muy bajo.
“Lo lógico es tener anticuerpos y linfocitos T reactivos a la vez, pero estamos en los umbrales de detección de las técnicas. Ya se han visto casos por parte de inmunólogos de la sociedad en sus proyectos de investigación con respuesta celular positiva y anticuerpos negativos”, señala la especialista .
“También -añade- se pueden perder anticuerpos y que sigamos teniendo los linfocitos B de memoria preparados para producirlos si entramos otra vez en contacto con el virus, estas células B tienen una vida media de hasta 20 años”, explica la inmunóloga.
Inmunidad innata e inmunidad adaptativa
El ser humano presenta diferentes y complejas respuestas inmunitarias frente a las amenazas.
Si un virus entra en el organismo la primer línea de defensa que actúa en cuestión de horas es la inmunidad innata, compuesta por células como neutrófilos o células dendrítícas, que al reaccionar rápidamente podrían incluso frenar la infección.
Precisamente, otra de las investigaciones abiertas intenta averiguar si hay personas con una respuesta inmune innata tan potente que elimine el virus antes de que se activen las otras líneas de defensa del organismo y por tanto no dejarían rastro de memoria inmunitaria.
Pero si la inmunidad innata no controla la infección, entra en días o semanas en el campo de batalla la segunda línea de defensa, la inmunidad adaptativa, integrada por los linfocitos B (los productores de anticuerpos) y los linfocitos T, los soldados que se lanzan contra el virus.
Estos linfocitos T son de dos tipos:
- CD4: Los generales, los que organizan la batalla con la respuesta inmune más adecuada mediante los anticuerpos que generan los linfocitos B o mediante las células defensivas.
- CD8: Son los soldados de infantería que combaten cuerpo a cuerpo contra el virus.
“Casi siempre se ataca por los dos frentes, aunque en general en los virus es más importante la respuesta celular y para las bacterias la humoral o de anticuerpos, pero siempre se activan las dos”, señala Carmen Cámara.
¿Conocer más sobre las distintas respuestas inmunes es necesario a la hora de desarrollar una vacuna? “Es fundamental y creo que los laboratorios farmacéuticos van a tener un interés claro en esa investigación”, concluye la inmunóloga Carmen Cámara.










 Farmacias abiertas y de urgencia más cercanas
Farmacias abiertas y de urgencia más cercanas