FUENTE: Diario Médico
La FDA estadounidense ha anunciado hoy la aprobación por el procedimiento acelerado de Aduhelm -aducanumab-, de la biotecnológica norteamericana especializada en neurociencias Biogen, para el tratamiento del Alzheimer.
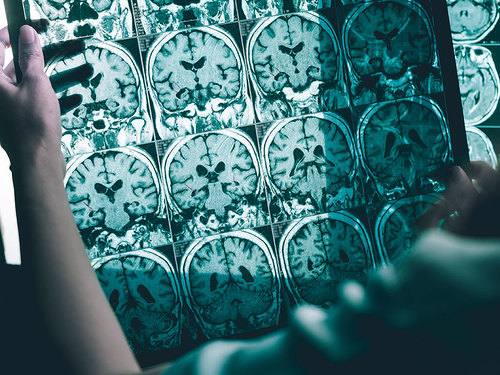
Aducanumab es un anticuerpo monoclonal que se une y puede reducir las placas beta-amiliodes presentes en el cerebro de los pacientes con Alzheimer, pudiendo así eventualmente frenar la progresión de la enfermedad.
La vía acelerada empleada por la agencia reguladora se emplea para medicamentos indicados en el tratamiento de enfermedades graves o que comprometen la supervivencia cuando éstos proporcionan un avance terapéutico significativo frente a las alternativas existentes.
Según ha señalado Patrizia Cavazzoni, directora del Centro para la Evaluación e Investigación de Medicamentos del a FDA, las alternativas disponibles para el Alzheimer en la actualidad "solo tratan los síntomas de la enfermedad", mientras que el tratamiento aprobado hoy "es la primera terapia que se dirige a la patofisiología fundamental de la enfermedad". Como se ha visto en la lucha contra el cáncer, la aprobación acelerada puede ofrecer tratamientos a pacientes de manera más ágil, mientras se sigue investigando e innovando".
Primero, desde 2003
Aduhelm es el primer tratamiento de este tipo que recibe la aproabación de la FDA para esta enfermedad, y es también el primero que autroriza la agencia americana en Alzheimer desde 2003. Para su aprobación, el organismo se ha basado en los resultados de eficacia de Aduhelm en tres estudios diferentes entre un total de 3.482 pacientes, de los que aquellos que recibieron el medicamento experimentaron una reducción significativa de las placas beta-amiloides dosis-dependiente y asociada a la duración del tratamiento, cuantificadas con estudios PET, mientras que los que recibieron placebo no tuvieron reducción alguna.
Según los términos de la aprobación acelerada, la FDA requiere a Biogen que lleve a cabo un nuevo ensayo randomizado y controlado para vericar el beneficio clínico del fármaco, al que se le podría retirar la autorización emitida hoy si no logra este objetivo.









 Farmacias abiertas y de urgencia más cercanas
Farmacias abiertas y de urgencia más cercanas